Глиомные клетки обмениваются друг с другом вирус-подобными частицами с мРНК
Белок Arc (Activity-regulated cytoskeleton-associated) играет важную регуляторную роль в процессах коммуникации между нейронами в головном мозге через специальные контакты – синапсы. Чем выше активная площадь синаптических контактов и чем больше плотность рецепторов на постсинаптической мембране, тем межнейронная связь сильнее. Процесс «усиления» межнейронных контактов играет важную роль в механизмах, связанных, например, с формированием памяти и другими когнитивными функциями. Arc может как усиливать, так и ослаблять синаптические контакты.
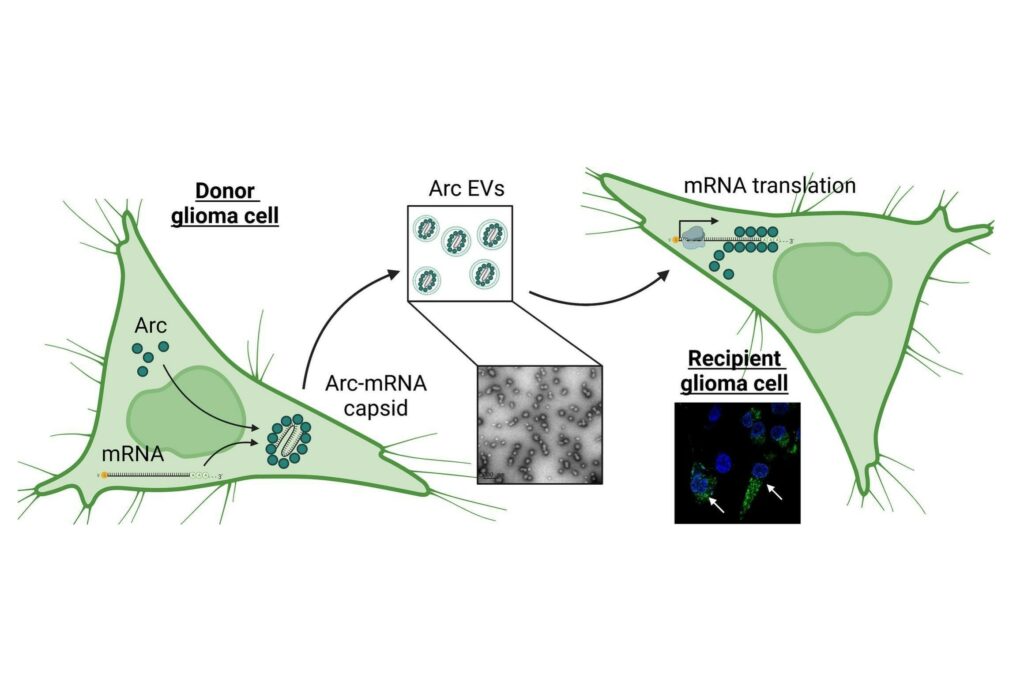
Интересно, что ген белка Arc имеет вирусное происхождение. По-видимому, он был «одомашнен» в ходе эволюции от группы РНК-содержащих вирусов, называемых ретровирусами. Белок Arc способен образовывать капсиды – белковые «контейнеры» для генетического материала – мРНК. В этом капсидном контейнере с помощью внеклеточных пузырьков мРНК может передаваться от одного нейрона к другому. Возможно, этот механизм также играет существенную роль в формировании и регуляции силы синаптических контактов.
Синапсы образуются не только между нейронами. Как показали недавние исследования, клетки глиом, злокачественных опухолей мозга, также могут формировать синапсы с нейронами. Благодаря образованию нейроглиомных синапсов опухолевые клетки получают биохимические сигналы, способствующие их выживанию, стимулирующие их деление и лекарственную устойчивость.
«В свете этих фактов мы задались вопросом, а не могут ли глиомные клетки так же выделять и обмениваться везикулами с мРНК-содержащими капсидами из белка Arc, как это делают нейроны?» – комментирует кандидат биологических наук Михаил Дурыманов, руководитель проекта, заместитель заведующего лабораторией специальных клеточных технологий МФТИ.
Ученые обнаружили, что белок Arc был высоко экспрессирован в нескольких глиомных клеточных линиях человека. Этот белок, а также кодирующая его мРНК, были обнаружены в составе внеклеточных пузырьков, выделяемых глиомными клетками. Сами пузырьки с капсидами Arc отличались от остальных внеклеточных везикул более мелким диаметром, сравнимым с размером ретровирусных частиц, их продукция значительно возрастала в клетках с повышенной экспрессией Arc, а глиомные клетки с искусственно вырезанным геном Arc их не выделяли. Исследователи показали, что мРНК-содержащие везикулы с Arc были способны поглощаться реципиентными глиомными клетками путем макропиноцитоза, после чего доставленная таким образом мРНК транслировалась в функциональный белок.
«Потом мы решили выяснить, насколько большой вклад выявленный механизм обмена вирусоподобными частицами вносит в обмен мРНК между глиомными клетками», – объясняет Айя Аль Осман, аспирантка лаборатории специальных клеточных технологий МФТИ.
Чтобы ответить на этот вопрос, ученые из исходной глиомной линии получили клетки, которые экспрессировали либо красный (red fluorescent protein, RFP), либо зеленый флуоресцентный белок (green fluorescent protein, GFP). При этом в «красных» клетках ген, кодирующий Arc белок, был искусственно удален. Из «зеленых» часть была также с выключенным геном Arc, а часть – с его повышенной экспрессией. Далее «красные» клетки культивировали совместно с «зелеными» клетками, в которых экспрессия Arc была либо подавлена, либо усилена.
Поскольку Arc может формировать комплексы и переносить в реципиентные клетки любую мРНК, включая ту, что кодирует GFP, то сравнение доли клеток с двойной экспрессией RFP и GFP в двух совместных культурах помогло установить вклад Arc в обмен мРНК между глиомными клетками. Оказалось, что наличие экспрессии Arc приводило к возрастанию числа «двухцветных» клеток в три раза. Из этого исследователи сделали вывод, что механизм передачи информации с помощью внеклеточных пузырьков с комплексами мРНК/Arc вносит значительный вклад в «общение» глиомных клеток друг с другом.
«Не исключено, что данный механизм обмена мРНК при участии белка Arc возможен не только между глиомными клетками, но и между глиомными клетками и нейронами, что, возможно, может способствовать формированию нейроглиомных синапсов. Эту гипотезу предстоит проверить в скором будущем», – подытожил Михаил Дурыманов.
В работе принимали участие ученые из Физтех-школы биологической и медицинской физики МФТИ, Федерального медико-биологического агентства, МГУ имени М.В. Ломоносова, и Национального медицинского исследовательского онкологического центра им. Н.Н. Блохина.
Работа выполнена при поддержке гранта Российского научного фонда и опубликована в журнале Biochimica et Biophysica Acta (BBA) – General Subjects.
Источник: Пресс-служба МФТИ