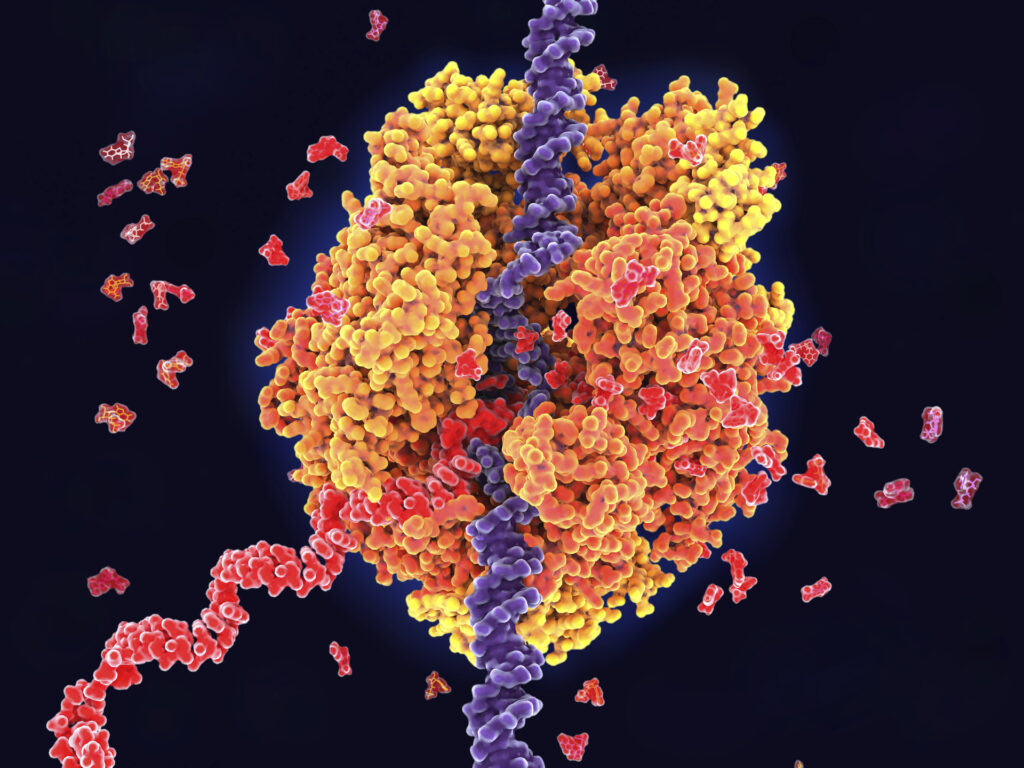
Починка антисмысловой нити: учёные открыли механизм восстановления повреждений цепочки ДНК
Российские учёные в составе международной исследовательской группы раскрыли молекулярный механизм, который запускает починку нити ДНК, отвечающей за деление клетки. Ранее науке был известен лишь механизм репарации той нуклеотидной цепочки, которая обеспечивает экспрессию (синтез) белков в организме. «Починка» ДНК начинается после того, как молекула фермента РНК-полимеразы наталкивается на повреждения в этой цепочке, двигаясь вдоль неё. Оказалось, что разрывы второй нити ДНК тоже меняют эту структуру, что позволяет клетке отреагировать на поломки генома. По словам авторов работы, результаты исследования помогут найти новые методы лечения ряда заболеваний.
Российские учёные из МГУ им. М.В. Ломоносова и Института биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова РАН совместно с коллегами из Университета МГУ-ППИ в Шэньчжэне (Китай), Медицинской школы Рутгерса Роберта Вуда Джонсона (США) и Центра исследования рака Фокс Чейз (США) раскрыли механизм, который обеспечивает устранение поломок в одной из нитей ДНК.
Об этом RT сообщила пресс-служба Российского научного фонда (РНФ). Результаты опубликованы в журнале Cells. Исследование поддержано грантом Президентской программы РНФ.
Молекула ДНК состоит из двух нуклеотидных цепочек, закрученных в спираль. Одна из этих нитей задействуется в процессе транскрипции — считывания генов для экспрессии (синтеза) белков, необходимых для функционирования организма. Эта нить носит название «смысловая», напоминают авторы исследования. Вторая нить используется только для копирования ДНК при делении клетки — биологи называют её антисмысловой.
Под влиянием неблагоприятных внешних факторов цепочки ДНК могут получать повреждения и разрываться. Кроме того, брешь образуется при клеточном делении, когда ДНК копируется. За сутки в клетках человеческого организма может происходить до 100 тыс. таких разрывов. Поломки исправляются благодаря механизму репарации — выработке специальных белков, которые способны «залатать» разрывы. В противном случае повреждение даже одной нити ДНК приводило бы к злокачественному перерождению или гибели всей клетки.
Распознавание повреждений в цепочке ДНК происходит при помощи специальных ферментов. Во время считывания генетического кода с нити ДНК молекула фермента РНК-полимеразы движется вдоль цепочки нуклеотидов. Встретив разрыв нити, молекула останавливается — это служит сигналом для запуска процесса репарации.
Однако этот механизм действует только в отношении смысловой нити ДНК — РНК-полимераза движется только по этой цепочке. При этом науке до сих пор было неизвестно, каким образом «чинятся» поломки и разрывы второй, антисмысловой нити ДНК.
Авторы научной работы смогли раскрыть этот механизм. С помощью электронной микроскопии, биохимических методов и молекулярного моделирования учёные изучили конфигурацию цепочек нуклеиновой кислоты на участке считывания генетической информации РНК-полимеразой. Когда молекула фермента движется по нити ДНК, цепочка нуклеотидов закручивается в петли, которые раскрываются по мере продвижения молекулы.
Выяснилось, что геометрия этих петель сильно меняется, если в соседней антисмысловой нити есть повреждение. Благодаря этим изменениям клетка способна обнаружить разрыв на антисмысловой цепочке ДНК, считают биологи.
Наличие разрыва на антисмысловой нити не позволяет петлям комплементарной (взаимодополняющей) цепочки принять правильную конфигурацию и продвижение РНК-полимеразы останавливается. Таким образом, петли служат индикаторами разрывов в антисмысловой цепи, этот механизм запускает процесс исправления ошибок в геноме, поясняют учёные.
«Мы открыли новый механизм, с помощью которого клетка может находить разрывы в ДНК. Понимание этого механизма имеет большое значение для фундаментальной науки: повреждение ДНК ведёт к накоплению мутаций и, как следствие, смерти или нарушению работы клетки. Это способствует развитию различных заболеваний, в том числе онкологических и нейродегенеративных», — пояснила в беседе с RT доктор биологических наук профессор биологического факультета МГУ, профессор РАН Ольга Соколова.
Исследователи отмечают, что этот ранее неизвестный науке механизм может открыть новые возможности лечения ряда заболеваний, связанных с генетическими сбоями. Кроме того, полученные данные могут стать отправной точкой для разработки препаратов, способных снижать стабильность ДНК и вызывать программируемую гибель раковых клеток, а также клеток, поражённых вирусами, полагают учёные.
Фото: JUAN GAERTNER/SCIENCE PHOTO LIBRARY