Полногеномная реконструкциия в преимплантационном генетическом тестировании – поможет ли новый метод избежать риска развития полигенных заболеваний?
В последние годы в сфере вспомогательных репродуктивных технологий набирает популярность практика преимплантационного генетического тестирования (ПГТ). Это исследование позволяет предсказать генетические патологии у плода путем скрининга клеток, полученных при биопсии эмбриона на третий или пятый день развития. Благодаря этой методике становится возможным повысить эффективность процедуры ЭКО, снизив процент замерших беременностей и самопроизвольных абортов, а также выявить анэуплоидные эмбрионы и те, что имеют наследственные заболевания (в том числе сцепленные с полом). В то время как большинство процедур ПГТ нацелено на определение мутаций в конкретном гене, вызывающие редкие и тяжелые заболевания, большинство гораздо более распространенных болезней, таких как порок сердца, диабет второго типа, рак, возникают из-за мутаций в нескольких генах одновременно. Метод полногеномного секвенирования в данном случае также ограничен ввиду высокой стоимости и трудоемкости из-за того, что ДНК, полученная из одной или нескольких клеток эмбриона, имеет критически малый объем и, зачастую, низкое качество.
В исследовании участвовали 110 эмбрионов от 10 пар. Ученым удалось оценить риски 12-ти синдромов, включая некоторые виды рака, а также сердечные и аутоиммунные заболевания. Впоследствии полученные результаты сравнивали с данными секвенирования геномов уже рожденных малышей, и оказалось, что предсказанное имело точность в 97-99%.
Для того, чтобы осуществить метод ПГР, выполнили полногеномное секвенирование ДНК родителей с высоким значением покрытия. Комбинация молекулярных и статистических подходов позволила ученым связать родительские гены в «гаплотипы» (совокупность аллелей на участках одной хромосомы, которые наследуются вместе), которые соответствовали отдельным хромосомам, определить сайты мейотической рекомбинации и собрать соответствующие сегменты гаплотипа, чтобы воссоздать весь унаследованный геном эмбриона. Эффективность прогнозирования зависела от срока развития зародыша: при биопсии эмбрионов на третий день она составила около 97%, а на четвертый – 99%.
Ученые рассмотрели вариативность риска полигенных заболеваний среди эмбрионов, полученных от разных пар, а также между эмбрионами каждой пары. Наибольшая вариативность возникала в случае аутоимунных заболеваний, таких как сахарный диабет 1-го типа или витилиго, однако риск их развития составлял менее 10% ввиду их редкости как для эмбрионов-сиблингов, так и для зародышей от разных семей. Наибольшие значения риска обнаруживались для более распространенных заболеваний, таких, как болезни сердца.
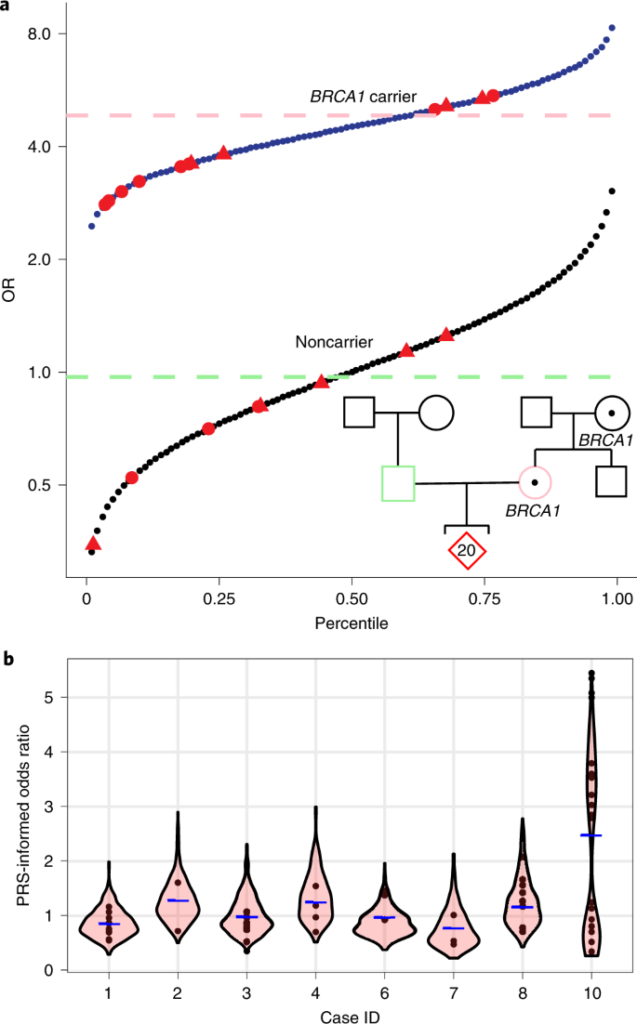
Часть работы, в которой оценивался критерий прогнозирования риска развития заболевания в рамках выбора эмбриона для переноса в матку, вызывает большой интерес. Так, исследователи изучили результаты ПГТ пары, в которой мать являлась носителем патологического варианта гена BRCA1, одного из факторов, вызывающих рак груди. В семейном анамнезе этой пары также были случаи заболевания раком груди. Из 20 эуплоидных эмбрионов 13 имели патологический вариант гена BRCA1. Исследователи использовали полигенную шкалу рисков, которая прогнозирует шансы развития заболевания на основании данных секвенирования биоптата, и статус носительства патологического варианта BRCA1 в роли отдельных переменных. Внутри группы эмбрионов, полученных от одной пары, прогнозируемый риск развития рака груди у эмбрионов-носителей превышал таковой у их сиблингов, не являющихся носителями, в 15 раз. Однако, в группе эмбрионов, в которой не было носителей патологического варианта BRCA1, оказались зародыши с высокими показателями полигенной шкалы риска. Также обнаружилось, что в группе эмбрионов-носителей этого гена присутствовали имеющие как высокие значения полигенной шкалы риска, так и низкие.
Фото: подготовлено Алёшиной Н.М, сайт ИБР РАН